
Diabete e tumore al pancreas
Gennaio 13, 2020
App iRisk per valutare il rischio di sviluppare un tumore pancreatico
Febbraio 20, 2020La Dott.ssa Elide Spinelli e’ un medico genetista presso l’ospedale Fondazione Poliambulanza di Brescia. Laureata in Medicina e Chirurgia presso l’Universita’ di Brescia, ha conseguito poi la specializzazione in genetica medica, ha lavorato in diverse strutture ospedaliere della provincia per poi approdare in Fondazione Poliambulanza nel 2018. Insieme al team multidisciplinare, Elide si occupa di capire la genetica in pazienti con tumore al pancreas. Abbiamo chiesto alla Dott.ssa Spinelli di spiegarci l’abc della genetica, del suo coinvolgimento in questa malattia e di aiutarci a capire la familiarita’.

1) Cos’è il DNA e cosa sono le mutazioni genetiche? Il DNA è la molecola più importante contenuta nelle nostre cellule, è una sottilissima catena a doppia elica di acido desossiribonucleico, arrotolata su sé stessa a formare tanti gomitoli di dimensioni e forme diverse (che si chiamano cromosomi). Ogni nostra cellula contiene 46 cromosomi, 23 coppie, e ciascun membro di una coppia ci è donato da uno dei nostri genitori.
Ogni cromosoma, come i volumi di un manuale tecnico, immaginiamo un voluminoso manuale formato da 46 volumi uguali a due a due (es volume 1p – dato dal padre, volume 1m – dato dalla madre, volume 2p e 2m e così via) contiene dei tratti di DNA che racchiudono le informazioni necessarie a costruire una minima parte del nostro organismo, una proteina, un enzima, un componente di una cellula o altre molecole. Questo tratto di DNA che codifica per una proteina o un altro componente cellulare (NB: “codifica” significa contiene le informazioni che per mettono di costruire una molecola), è chiamato GENE.
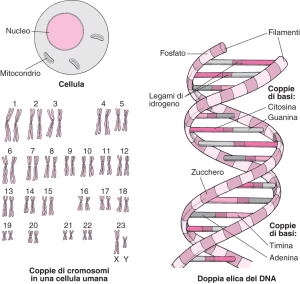
Ogni gene lo si può immaginare come un capitolo di un volume (che è il cromosoma) dell’intero manuale di istruzioni che le nostre cellule contengono e che si chiama GENOMA. Tutte le nostre cellule contengono un corredo cromosomico completo di 46 cromosomi, tranne le cellule germinali mature (oocita o spermatozoo), che contengono 23 cromosomi, vista la loro funzione riproduttiva.
2) Qual è la differenza tra DNA ereditario e DNA SOMATICO? Ogni nostra cellula contiene una copia del DNA che deriva dal genoma dell’oocita e dello spermatozoo uniti nelle prime fasi di fecondazione e sviluppo embrionale. Da questa prima cellula deriva tutto il nostro organismo completo in un susseguirsi di replicazioni cellulari che fa sì che in 9 mesi si arrivi alla nascita di un neonato, il quale a sua volta raggiungerà uno sviluppo fisico completo dopo lo sviluppo puberale. Dopo questa fase molte cellule del nostro organismo mantengono un certo tasso di replicazione senza far crescere in volume gli organi cui appartengono, perché i tessuti invecchiano ed è importante che nuove cellule sostituiscano quelle senescenti che da sole vanno incontro a morte programmata. Ora, se un genitore è portatore di una mutazione in un gene che causa una patologia trasmissibile attraverso il DNA delle cellule germinali, il feto erediterà la mutazione in quanto esso stesso è prodotto del concepimento di uno spermatozoo o di un oocita che contengono DNA mutato, di conseguenza ogni cellula dell’organismo di quel feto che poi nascerà sarà portatore di una mutazione che noi chiamiamo GERMINALE, cioè trasmissibile alla progenie tramite le cellule germinali. Un esempio è una malattia che si trasmette da genitore a figlio, come nel caso di acondroplasia, ipercolesterolemia familiare ecc. Quando invece, come accennato in precedenza, un tessuto va incontro ad invecchiamento naturale, è possibile che, di replicazione in replicazione o a causa di agenti esterni come radiazioni o agenti chimici, in una di queste cellule il DNA vada incontro a mutazioni, che possono essere trasmesse alle cellule figlie e, se non riparate dai normali meccanismi di riparo del DNA presenti nella cellula, causino una deriva strutturale e funzionale della cellula stessa fino a farla diventare un elemento assolutamente diverso dalla cellula madre, come accade nel caso dei tumori.
3) Quali sono le mutazioni che aumentano la probabilità di sviluppare il tumore del pancreas? Qualora si erediti una mutazione germinale in un gene come BRCA1 o BRCA2, coinvolti entrambi nei processi di riparo delle rotture dei filamenti di DNA, è possibile che si sia maggiormente esposti al rischio di sviluppare neoplasia del pancreas. Ovviamente questi geni non sono gli unici potenzialmente coinvolti, esistono diverse forme ereditarie di tumore che aumentano il rischio di sviluppare carcinoma del pancreas.

4) Esiste familiarità per il tumore al pancreas? Si stima che il 10% dei casi di tumore pancreatico diagnosticati in un anno sia familiare e il 5% sia dovuto a sindromi di predisposizione allo sviluppo di tumore familiari. La familiarità positiva nel vaso del tumore pancreatico si ha qualora due soggetti parenti di primo grado tra loro in una famiglia ne siano affetti, indipendentemente dall’età.
5) A quali test genetici vengono sottoposti i pazienti con tumore al pancreas? E i familiari? I geni coinvolti nella patogenesi del carcinoma del pancreas sono numerosi e possono determinare l’insorgenza di sindromi ereditarie in cui diversi organi sono interessati alla genesi di tumori ricorrenti nelle famiglie in cui sono trasmessi i geni mutati. Tra i geni più comunemente noti in queste sindromi cancerose ereditarie troviamo BRCA1, BRCA2, PTEN, P53, APC,MUTYH, CHEK2, XRCC1, MLH1,PMS2,MSH2, MSH6, e tanti altri. Alcuni di questi geni hanno il compito di riparare i danni da rottura del DNA, altri geni, controllano l’avanzamento della cellula nelle diverse fasi del ciclo di replicazione cellulare, altri inducono una proliferazione cellulare in risposta a stimoli intra o extracellulari, potremmo vederli come tanti operai che lavorano in una catena di montaggio: alcuni montano i pezzi, altri fanno avanzare la catena, altri eseguono dei “controlli di qualità” del prodotto finito. Ad oggi il primo step nella ricerca di mutazioni familiari in pazienti affetti da carcinoma del pancreas è il test che ricerca mutazioni nei geni BRCA1 e BRCA2. Il test viene prescritto in corso di consulenza genetica che è il colloquio che il paziente, da solo o, come spesso accade, accompagnato da un familiare, tiene con il medico genetista. Lo scopo è quello di verificare la possibile presenza di forme ereditarie di tumore familiare, che possono essere forme “pure” di carcinoma pancreatico o casi in cui al cancro del pancreas si associano altri tipi di tumore, come quello della mammella, dell’ovaio, melanomi, carcinoma della prostata o del colon-retto. Il medico genetista stabilisce sulla base delle informazioni cliniche ottenute quale sia l’approccio diagnostico più efficace per la famiglia e il paziente. È anche possibile che si decida di eseguire un test multigenico che analizza un numero variabile di geni, dai 20 ai 50 circa in base alla disponibilità del laboratorio di genetica che esegue l’analisi, in cui comunque BRCA1 e BRCA2 devono essere compresi.

6) Cosa succede se un paziente scopre di avere una mutazione? Se si evidenzia una mutazione in un gene che causa una forma ereditaria di tumore, innanzitutto si comunica al paziente l’esito del test e il significato clinico dell’esito, in termini di terapia e percorso diagnostico per il paziente stesso e in termini di rischio per i familiari, che potranno sottoporsi alla ricerca della mutazione familiare, velocizzando i tempi di ricerca dei soggetti a rischio e “messa in sicurezza” degli stessi, mediante, se possibile, percorsi di screening personalizzati.
7) Che cosa è la mutazione BRCA e perché è importante? I geni BRCA1 e BRCA2, come già anticipato, sono due “riparatori” del DNA. Recentemente, a causa della loro attività chiave per il mantenimento dell’integrità del DNA cellulare, sono stati oggetto di numerose e fruttuose ricerche scientifiche, di base prima e cliniche poi. Questo percorso ha portato alla produzione e alla messa sul mercato di farmaci che inibiscono la crescita del tumore o di metastasi in pazienti portatori di mutazioni BRCA1/BRCA2. I primi studi sono stati condotti sulle pazienti con carcinoma ovarico, quindi alla mammella e nell’ultimo anno i farmaci PARP-INIBITORI (Olaparib), questo è il nome tecnico, sono stati approvati negli USA e in UE per il cancro del pancreas e della prostata.
8) Che cosa si intende per sorveglianza in soggetti a rischio di sviluppare tumore al pancreas? Quando si trova una famiglia con rischio elevato di sviluppare un tumore, qualunque esso sia, è dovere dei medici che identificano la famiglia e, all’interno della stessa, identificano i soggetti a rischio di ammalarsi di tumore (ricordiamo sempre che non si eredita un tumore, si eredita il rischio di ammalarsi di un tumore!) dare delle indicazioni cliniche in merito a quali esami eseguire, da che età e con che frequenza o quali possibilità di minimizzare il rischio neoplasia sono disponibili. Nel caso del tumore al pancreas la sorveglianza oncologica è molto limitata e le linee guida ad oggi non danno indicazioni sul percorso diagnostico precoce se non suggerendo di inviare i pazienti in centri ad alta specializzazione dove vi siano studi clinici in corso, che solitamente ricorrono a tecniche di imaging come RMN addome o TC o ecografia addome. Questa forte limitazione diagnostica è una criticità particolarmente ostica. Certamente non può rappresentare uno scoglio oltre il quale saremo costretti a fermarci ancora per lungo tempo.
9) Qual è l’approccio di Fondazione Poliambulanza per quanto riguarda la genetica del tumore al pancreas? Chi riceve l’analisi genetica? Il percorso diagnostico del paziente con carcinoma del pancreas è conforme alle linee guida più attuali: i pazienti che seguono un percorso terapeutico oncologico associato o meno a chirurgia vengono inviati in consulenza genetica, in base ai dati emersi in corso di colloquio potranno sottoporsi a test genetico e riceveranno gli esiti del test in un secondo incontro con il medico genetista che spiegherà loro il significato del risultato della analisi e darà indicazioni al paziente e ai colleghi su eventuali integrazioni del percorso di follow up o terapia e sulla necessità di testare anche i familiari del paziente. Questo percorso è ovviamente parte di un approccio multidisciplinare oggi imprescindibile per patologie complesse come i tumori.
10) Spesso i pazienti chiedono di avere informazioni riguardanti la loro genetica e nella maggior parte dei casi non vengono ascoltati. Qual è il suo suggerimento? Affidarsi a un esperto in materia è sempre il miglior suggerimento: l’ambulatorio di genetica è la sede ideale in cui discutere del rischio oncologico sulla base della propria storia familiare, è bene arrivare alla consulenza genetica con il maggior numero di informazioni possibili in merito alle patologie che ricorrono in famiglia, all’età in cui sono state diagnosticate, all’età del decesso dei parenti che non sono sopravvissuti. Sarà il medico genetista a decidere sulla base di linee guida e criteri clinici se il paziente può sottoporsi a un test genetico, decidendo anche quale test è più utile per il paziente stesso e, nel caso in cui non sia necessario eseguire un test genetico, darà consigli su quali esami clinici effettuare e con quale cadenza per identificare il più precocemente possibile una patologia neoplastica. Infine, ci tengo a specificare che i test genetici rientrano tra gli esami riconosciuti dal sistema sanitario nazionale come prescrivibili mediante ricetta SSN, quindi non è assolutamente vero che il costo dei test genetici è interamente a carico del paziente, questi test sono disponibili mediante pagamento del ticket sanitario, o in esenzione se i pazienti hanno esenzioni specifiche, se prescritti da un medico genetista o uno specialista. Invito i pazienti a rivolgersi a professionisti e non lasciarsi tentare dai test fai-da-te sempre più diffusi online, interpretare i risultati di un test molecolare non è sempre immediato, a volte è complesso anche per il clinico specialista che lo ha prescritto, serve formazione e serve un percorso clinico serio. La genetica è una branca relativamente giovane della medicina e in fortissima espansione, può sembrare una specializzazione molto lontana dalla medicina “classica” fatta di cure, farmaci, interventi chirurgici e medicazioni, spesso i pazienti entrano in ambulatorio convinti di dover solamente compilare moduli per eseguire un prelievo del sangue e rimangono sconcertati quando iniziano le domande in merito alla loro storia clinica e alla loro famiglia o quando si discute dei possibili esiti del test e degli scenari terapeutici possibili in base ai risultati. Serve conoscere le patologie dei pazienti, il percorso di cura, serve un approccio clinico e comunicativo che si adatta alle diverse tipologie di pazienti che nell’arco della giornata entrano dalla tua porta, dal bambino all’anziano, è un atto medico e non una pratica burocratica che, come spesso accade, si esaurisce online.
Per saperne di piu’: https://www.poliambulanza.it/personale_medico/spinelli-elide





